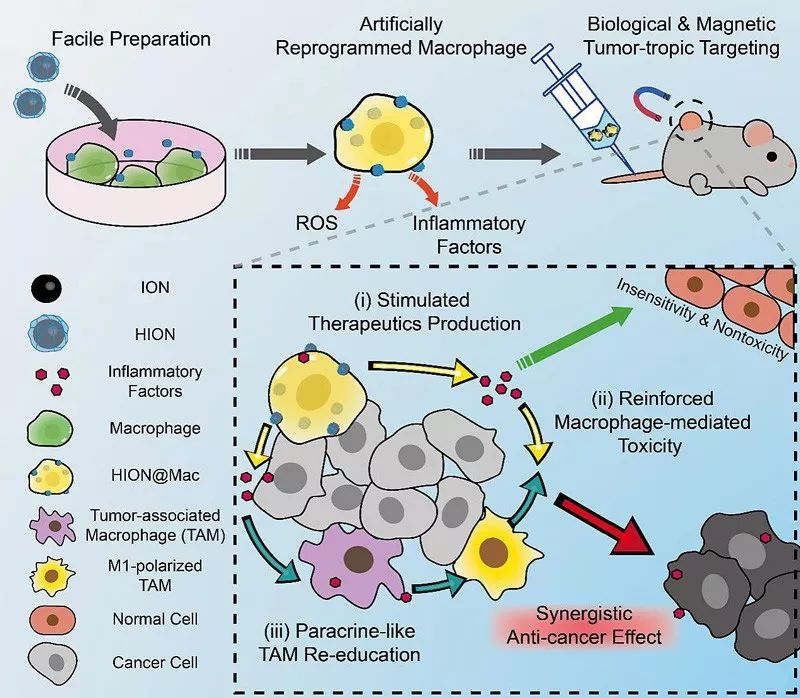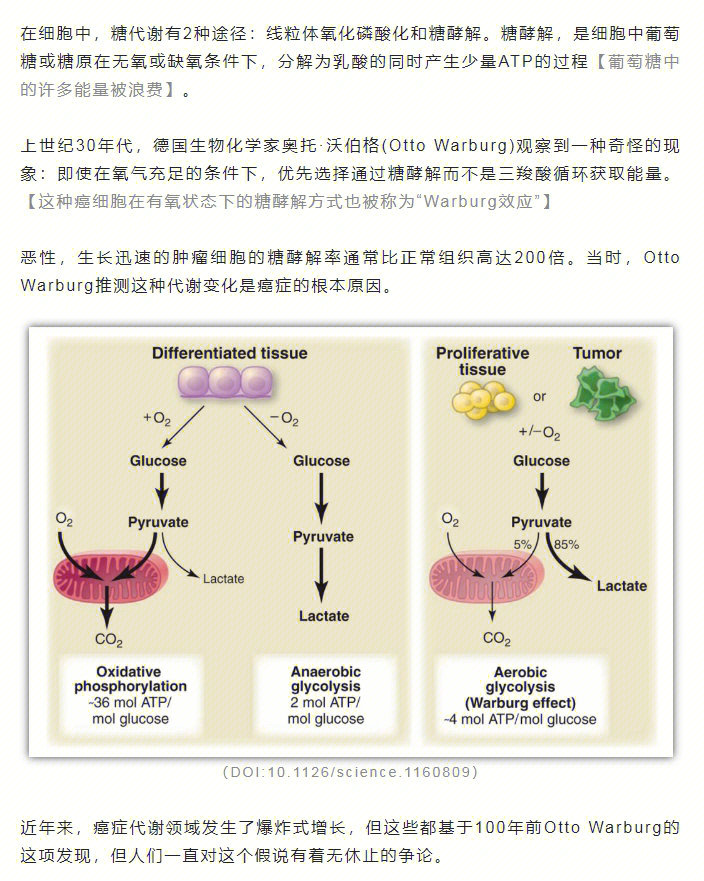
有大量的基础研究发现热量限制可以抑制肿瘤的生长。
还有一些研究将葡萄糖水平的变化,与肿瘤细胞中p53蛋白的水平和活性联系了起来。例如,葡萄糖限制会导致p53的水平升高和激活[2,3]。
从p53激活的角度来说,第15和20位丝氨酸被磷酸化之后,会维持p53的稳定性,进而导致细胞周期停滞,肿瘤生长停止[4]。这也是热量限制抑制肿瘤生长的原因之一。
不过,p53还有一个更强劲的抗癌功能,那就是诱导细胞凋亡。激活这一功能,需要磷酸化p53的第46位丝氨酸。然而,目前还不清楚葡萄糖及其糖酵解代谢产物,是否可以激活p53的这一功能。
林圣彩团队首先证实,5mM以下浓度的葡萄糖确实会导致p53第46位丝氨酸的磷酸化特异性增加。

既然如此,那究竟是葡萄糖自身,还是其代谢产物影响了p53第46位丝氨酸的磷酸化呢?
他们围绕糖酵解通路展开了地毯式排查,最后确定不是葡萄糖,而是其代谢产物3-磷酸甘油酸(3-PGA)在调节p53第46位丝氨酸的磷酸化。
糖酵解路径
接下来的问题是:究竟是谁通过3-PGA感知到了血糖的变化,最终调节了p53第46位丝氨酸的磷酸化。
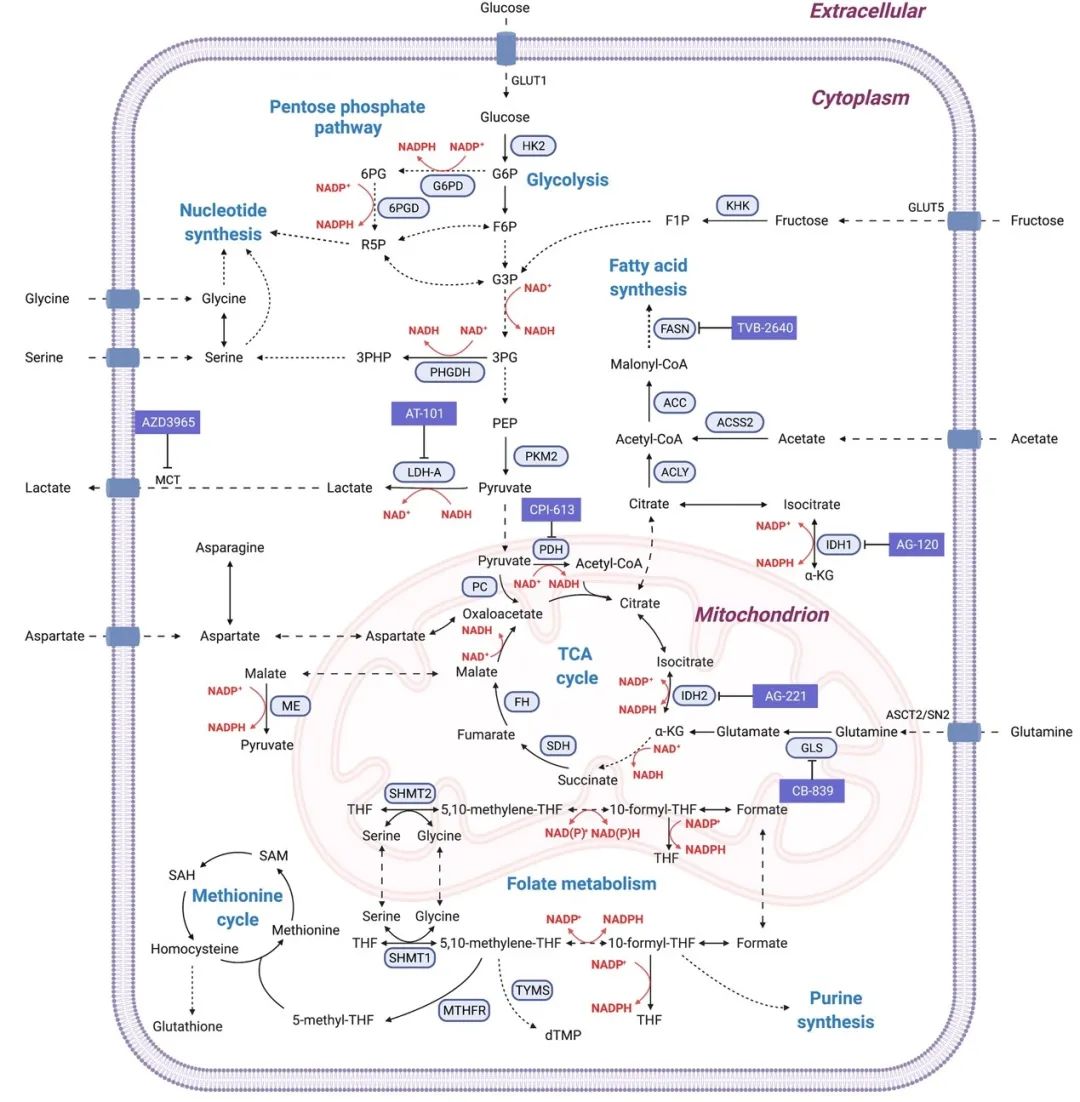
三磷酸甘油酸脱氢酶(PHGDH)从免疫共沉淀实验中脱颖而出。后续实验证实,PHGDH不仅能与3-PGA结合,而且还能与p53蛋白发生直接的相互作用。
更重要的是,低葡萄糖水平会增强PHGDH与p53的相互作用,而加入3-PGA后,PHGDH与p53的相互作用就会被抑制。
不过,需要注意的是,PHGDH作为一种酶,具有催化活性,是催化3-PGA合成丝氨酸的关键酶。因此,要搞清楚究竟是PHGDH的结合能力,还是它的催化能力在影响p53的磷酸化。
于是,林圣彩团队构建了PHGDH的多种突变体,有的只具有结合能力而失去催化能力,有的则完全失去结合能力。实验结果显示,作为3-PGA的直接感受器,PHGDH将低葡萄糖信号传递给p53只需要其结合能力,而与催化活性无关。
这一发现与之前的认知相反。之前有研究认为,PHGDH通过其催化作用,促进丝氨酸的合成,进而促进肿瘤的生长[5,6]。而这个研究发现,PHGDH的结合功能可以通过p53调节肿瘤的生长。
随着认知被刷新而来的,是PHGDH与3-PGA的结合究竟如何影响了p53第46位丝氨酸的磷酸化。
就在此时,林圣彩团队的注意力落在了20年前的一个研究上。
2004年,他们发现,紫外线诱导的DNA损伤,会导致乙酰转移酶TIP60和激酶HIPK2结合到支架蛋白AXIN上中涂品牌网,它们仨再与p53结合,形成一个复合物(AXIN-TIP60-HIPK2-p53),由HIPK2完成对p53第46位丝氨酸的磷酸化[7]。
那么,由PHGDH感知葡萄糖变化引起的p53磷酸化,会在此处与紫外损伤引起的p53磷酸化汇合么?
实验数据表明,二者确实汇合了。
在低葡萄糖水平下,细胞中的TIP60、HIPK2和AXIN水平都上升了。无论是破坏AXIN还是HIPK2,低葡萄糖水平都不能提高p53第46位丝氨酸的磷酸化水平。
在后续的研究中,林圣彩团队很快就发现,PHGDH与3-PGA的结合会阻止PHGDH与AXIN的结合,进而抑制了AXIN-TIP60-HIPK2-p53的形成,阻止p53第46位丝氨酸被磷酸化;而在葡萄糖水平较低的情况下,则相反。
至此,葡萄糖水平调节p53第46位丝氨酸的磷酸化水平,进而影响其调节细胞凋亡的机制就搞清楚了。
机制示意图
在研究的最后,林圣彩团队在肝癌小鼠模型中验证了上述机制的存在。值得一提的是,在肝癌患者的肿瘤组织中,也可以观察到3-PGA与p53第46位丝氨酸磷酸化水平之间的负相关性。
总的来说,林圣彩团队的这个研究表明,生理性低血糖可自主启动PHGDH-AXIN-TIP60-HIPK2-p53复合体的形成,导致p53第46位丝氨酸磷酸化水平增加,进而诱发细胞凋亡。
值得注意的是,已经有研究发现高血糖与肝癌发生有关[8],而热量限制饮食可以降低肝癌的发生风险[9]。这个发现在一定程度上也解释了这些现象。
来自:奇点网

 微信扫一扫打赏
微信扫一扫打赏